TABLA PERIÓDICA GRUPO A
CAMACHO 11-3

INTRODUCCIÓN
En el siguiente blog prendemos orientar el uso de las diferentes mitologías de aprendizajes en el área de química, por eso en esta ocasión hablaremos de la tabla periódica y lo todo lo que podemos encontrar en ella como los grupos IV, VA, VIA, VIIA, sobre este grupo hablaremos mas fondo como las características, el numero atómico.
En ese orden de ideas les daré a conocer esta información acerca de 4 importantes grupos de elementos, nombrando individualmente los que componen cada uno, características comunes y demás aspectos relevantes para poder su clasificación y reconocimiento.
OBJETIVOS
Explicar que es la tabla periódica,para que sirve y sus principales elementos.
Reconocerlos elementos con sus diferentes características
Aplicar los diferentes elementos
Identificarlas diferentes de la cada elemento.
TABLA PERIÓDICA
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones),por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas,como elementos con comportamiento similar en la misma columna. Las filas de la tabla se denominan períodosy las columnas grupos. Algunos grupos tienen nombres.Así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas similares. Debido a que las posiciones están ordenadas,se puede utilizar la tabla para obtener relaciones entre las propiedades de los elementos,o pronosticar propiedades de elementos nuevos todavía no descubiertoso sintetizados. La tabla periódica proporciona un marco útil para analizar el comportamiento químico yes ampliamente utilizada en química otras ciencias.
GRUPO IV A:
CARBOIDEOS El grupo IV A de la tabla periódica de los elementos también conocido como grupo del carbono o de los carbonoideos,está formado por los siguientes: elementos:
carbono (C), silicio (Si), germanio (Ge), estaño (Sn), pl omo (Pb), flerovio (Fl).
La mayoría de los elementos de este grupo son muy conocidos y difundidos,especialmente el carbono, elemento fundamental de la química orgánica.
CARBONO (C)

HISTORIA:
Descubridor Desconocido
Lugar de descubrimiento: Desconocido.
Año de descubrimiento: Antigüedad (prehistoria).
Origen del nombre: De la palabra latina "carbo",que significaba "carbón",donde el carbono es elemento mayoritario.
Obtención: El carbono en carbón, hulla y carbono amorfo,ha sido utilizado desde tiempos prehistóricos.
El carbono es único en la química porque forma un número de compuestos mayor que la suma total de todos los otros elementos combinados. Con mucho, el grupo más grande de estos compuestos es el constituido por carbono e hidrógeno.Se estima que se conoce un mínimo de 1.000.000 de compuestos orgánicos y este número crece rápidamente cada año. Aunque la clasificación no es rigurosa, el carbono forma otra serie de compuestos considerados como inorgánicos, en un número mucho menor al de los orgánicos. El carbono es el 15.º elemento más abundante en la corteza terrestre, y el cuarto elemento más abundante en el universo en masa después del hidrógeno, el helio y el oxígeno.La abundancia de carbono, su diversidad única de compuestos orgánicos y su inusual capacidad para formar polímeros a las temperaturas comúnmente encontradas en la Tierra, permite que este elemento sirva como un elemento común de toda la vida conocida.Es el segundo elemento más abundante en el cuerpo humano en masa (aproximadamente el 18,5%)después del oxígeno. CARACTERÍSTICAS GENERALES Nombre: Carbono Símbolo: C Número atómico: 6 Masa atómica (uma): 12,0107 Período: 2 Grupo: 14 (carbonoideos) Bloque: p (representativo) Números de oxidación: +2, +4, -4 PROPIEDADES PERIÓDICAS Configuración electrónica: [He] 2s2 2p2 Radio atómico (Å): 0,91 Radio iónico (Å): 2,6 (-4) Radio covalente(Å): 0,77 Energía de ionización(kJ/mol): 1087 Electro negatividad: 2,55 Afinidad electrónica (kJ/mol): 154
OBTENCIÓN DEL CARBONO:
El carbono se encuentra - frecuentemente muy puro - en la naturaleza, en estado elemental, en las formas alotrópicas diamante y grafito. El material natural más rico en carbono es el carbón (del cual existen algunas variedades).
Grafito: Se encuentra en algunos yacimientos naturales muy puro. Se obtiene artificialmente por descomposición del carburo de silicio en un horno eléctrico.
Diamante:Existen en la naturaleza, en el seno de rocas eruptivas y en el fondo del mar. En la industria se obtiene tratando grafito a 3000 K de temperatura y a una presión entre 125 - 150 katm. Por ser la velocidad de transformación de grafito en diamante muy lenta, se utilizan metales de transición, en trazas, como catalizadores (hierro, níquel, platino).
Carbón de coque:muy rico en carbono, es el producto residual en la destilación de la hulla.
Carbono amorfo:Negro de humo y carbón activo: Son formas del carbono finamente divididas. El primero se prepara por combustión incompleta de sustancias orgánicas; la llama deposita sobre superficies metálicas,frías, partículas muy finas de carbón. El carbón activo se obtiene por descomposición térmica de sustancias orgánicas.
Fullerenos: Estas sustancias se encuentran en el humo de los fuegos y en las estrellas gigantes rojas. Se obtienen, artificialmente, haciendo saltar un arco entre dos electrodos de grafito o sublimando grafito por acción de un láser.
COMPUESTOS DEL CARBONO:
- El dióxido de carbono se utiliza para carbonización de bebidas, en extintores de fuego y como enfriador(hielo seco,en estado sólido).
- El monóxido de carbono se emplea como agente reductor en procesos metalúrgicos.
- El tetracloruro de carbono y el de sulfuro de carbono se usan como disolventes industriales importantes.
- El freón se utilizaba en aparatos de refrigeración,hecho que está desapareciendo,debido alo dañino de este compuesto para la capa de ozono.
- El carburo cálcico se emplea para preparar acetileno y para soldar y cortar metales. Los carburos metálicos se emplean como refractarios.
- El carbono junto al hierro forma el acero.
APLICACIONES:
Grafito:
Construcción de reactores nucleares.
Construcción de electrodos para la industria electrolítica,por su conductividad eléctrica.
Lubricante sólido, por ser blando y untuoso.
Construcción de minas de lapiceros,la dureza de la mina se consigue mezclando el grafito con arcilla.
Construcción de crisoles de alta temperatura, debido al elevado punto de fusión del grafito.
Diamante:
Tallados en brillantes se emplean en joyería.
Taladradoras.
Cojinetes de ejes en aparatos de precisión.
Carbón de coque:
Se utiliza como combustible.
Se utiliza para la reducción de óxidos metálicos en metalurgia extractiva.
Negro de humo:
Colorante. Fabricación de tintas de imprenta.
Llantas de automóviles.
Carbón activo:
Absorbente de gases.
Catalizador. Decolorante.
Purificación de aguas potables.
En máscaras de gases.
En filtros de cigarrillos.
Fullerentos:
Propiedades conductoras,semiconductoras o aislantes, en función del metal con que se contaminen.
Lubricante
Fabricación de fibras.
EFECTOS DEL CARBONO EN LA SALUD: El carbono elemental es de una toxicidad muy baja. Los datos presentados aquí de peligros para la salud están basados en la exposición al negro de carbono, no carbono elemental. La inhalación continuada de negro de carbón puede resultar en daños temporales o permanentes a los pulmones y el corazón.
Se ha encontrado neumoconiosis en trabajadores relacionados con la producción de negro de carbón. También se ha dado parte de afecciones cutáneas tales como inflamación de los folículos pilosos,y lesiones de la mucosa bucal debidos la exposición cutánea.
Radioelectricidad negro de carbón ha sido incluido en la lista de la Agencia Internacional de Investigación del Cáncer (AIIC)dentro del grupo 3 (agente no clasificable con respecto a su carcinogenicidad en humanos).
El carbono-14 es uno de los radio nucleidos involucrados en las pruebas nucleares atmosféricas,que comenzó en 1945,con una prueba americana, y terminó en 1980 con una prueba china. Se encuentra entre los radio nucleidos de larga vida que han producido y continuarán produciendo aumento del riesgo de cáncer durante décadas y los siglos venideros. También puede atravesar la placenta, ligarse orgánica mente con células en desarrollo y de esta forma poner a los fetos en peligro.

HISTORIA:
Descubridor: Jöns Jacob Berzelius.
Lugar de descubrimiento: Suecia. Año de descubrimiento: 1824.
Origen del nombre: El nombre "silicio" deriva del latín "silex" (pedernal). Este nombre proviene de que los compuestos de silicio eran de gran importancia en la prehistoria: las herramientas y las armas, hechas de pedernal, una de las variedades del dióxido de silicio, fueron los primeros utensilios del hombre.
Obtención: Aunque, previamente, Davy pensaba que la sílice no era un elemento,no pudo descomponerla. En 1824,Berzelius obtuvo silicio amorfo al hacer reaccionar tetrafluoruro de silicio sobre potasio fundido. Al lavar el producto con agua obtuvo un polvo pardo que era silicio amorfo. En 1854,Sainte-Claire Deville preparó silicio cristalino por electrolisis de un cloruro impuro de sodio y aluminio. El silicio estaba contenido en el aluminio en forma de escamas brillantes, al eliminar el aluminio por disolución quedó el silicio cristalino.
Es el segundo elemento más abundante en la corteza terrestre (27,7 % en peso)después del oxígeno.Se presenta en forma amorfa y cristalizada; el primero es un polvo parduzco, más activo que la variante cristalina, que se presenta en octaedros de color azul grisáceo y brillo metálico. En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo.Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos,reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95 % de las longitudes de onda de la radiación infrarroja.Se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos.Se obtiene calentando sílice,o dióxido de silicio (SiO2), con un agente reductor, como carbono o magnesio,en un horno eléctrico.
SILICIO (SI)

HISTORIA:
Descubridor: Jöns Jacob Berzelius.
Lugar de descubrimiento: Suecia. Año de descubrimiento: 1824.
Origen del nombre: El nombre "silicio" deriva del latín "silex" (pedernal). Este nombre proviene de que los compuestos de silicio eran de gran importancia en la prehistoria: las herramientas y las armas, hechas de pedernal, una de las variedades del dióxido de silicio, fueron los primeros utensilios del hombre.
Obtención: Aunque, previamente, Davy pensaba que la sílice no era un elemento,no pudo descomponerla. En 1824,Berzelius obtuvo silicio amorfo al hacer reaccionar tetrafluoruro de silicio sobre potasio fundido. Al lavar el producto con agua obtuvo un polvo pardo que era silicio amorfo. En 1854,Sainte-Claire Deville preparó silicio cristalino por electrolisis de un cloruro impuro de sodio y aluminio. El silicio estaba contenido en el aluminio en forma de escamas brillantes, al eliminar el aluminio por disolución quedó el silicio cristalino.
Es el segundo elemento más abundante en la corteza terrestre (27,7 % en peso)después del oxígeno.Se presenta en forma amorfa y cristalizada; el primero es un polvo parduzco, más activo que la variante cristalina, que se presenta en octaedros de color azul grisáceo y brillo metálico. En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo.Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos,reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95 % de las longitudes de onda de la radiación infrarroja.Se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos.Se obtiene calentando sílice,o dióxido de silicio (SiO2), con un agente reductor, como carbono o magnesio,en un horno eléctrico.
OBTENCIÓN DEL SILICIO:
- Mediante aluminotermia a partir de la sílice,óxido de silicio, y tratando el producto con ácido clorhídrico en el cual el silicio es insoluble.
- Reducción de sílice con carbono o carburo de calcio en un horno eléctrico con electrodos de carbono.
- Reducción de tetracloruro de silicio con hidrógeno (para obtenerlo de forma muy pura).
- El silicio hiperpuro se obtiene por reducción térmica de triclorosilano, HSiCl3, ultra puro en atmósfera de hidrógeno y posterior fusión por zonas a vacío.
- APLICACIONES:
- Utilizado para producir chips para ordenadores. Las células fotovoltaicas para conversión directa de energía solar en eléctrica utilizan obleas cortadas de cristales simples de silicio de grado electrónico.
- El silicio hiperpuro puede doparse con boro, galio, fósforo o arsénico, aumentando su conductividad;se emplea para la fabricación de transistores, rectificadores otros dispositivos de estado sólido ampliamente empleados en electrónica.
- Se utiliza como integrante de aleaciones para dar mayor resistencias aluminio, magnesio,cobre y otros metales.
- La arena y arcilla (silicatos) se usan para fabricar ladrillos y hormigón; son un material refractario que permite trabajar a altas temperaturas.
- El metasilicato de sodio,Na2SiO3, es una sal empleada en detergentes para tamponar e impedir que la suciedad entre en el tejido: los iones metasilicatos,SiO3 -2 ,se unen a las partículas de suciedad,dándoles carga negativa, lo que impide que se agreguen y formen partículas insolubles.
- Al acidificar el orto silicato de silicio se obtiene un precipitado gelatinoso de sílice (sílica gel) que se emplea como agente desecante,soporte para catalizadores, cromolitografía y aislante térmico.
- La sílice (arena) es el principal ingrediente del vidrio, uno de los materiales más baratos con excelentes propiedades mecánicas, ópticas, térmicas y eléctricas.
- Las siliconas son derivados poliméricos del silicio. Se utilizan para juguetes, lubricantes, películas impermeables,implantes para cirugía estética, ...
- El carburo de silicio se utiliza como abrasivo importante, para componentes refractarios.
- EFECTOS DEL SILICIO EN LA SALUD:El silicio elemental es un material inerte, que parece carecer de la propiedad de causar fibrosos en el tejido pulmonar. Sin embargo,se han documentado lesiones pulmonares leves en animales de laboratorio sometidos a inyecciones intratraqueales de polvo de silicio. El polvo de silicio tiene pocos efectos adversos sobre los pulmones y no parece producir enfermedades orgánicas significativas o efectos tóxicos cuando las exposiciones se mantienen por debajo de los límites de exposición recomendados.El silicio puede tener efectos crónicos en la respiración. El silicio cristalino (dióxido de silicio) es un potente peligro para la respiración. Sin embargo,la probabilidad de que se produzca dióxido de silicio durante los procesamientos normales es muy remota. LD50 (oral)-3160 mg/kg. (LD50: Dosis Letal 50. Dosis individual de una sustancia que provocala muerte del 50% de la población animal debido a la exposición a la sustancia por cualquier vía distinta a la inhalación. Normalmente expresada como miligramos o gramos de material por kilogramo de peso del animal.)
- El silicio cristalino irrita la piel y los ojos por contacto. Su inhalación causa irritación de los pulmones y de la membrana mucosa.La irritación de los ojos provoca lagrimeo y enrojecimiento. Enrojecimiento,formación de costras y picores son características de la inflamación cutánea.
- El cáncer de pulmón está asociado con exposición esa silicio cristalino (especialmente cuarzo y cristobalita) en lugares de trabajo. En estudios realizados a mineros,trabajadores con tierra de diatomeas, trabajadores del granito, trabajadores de cerámica, trabajadores de ladrillos refractarios y otros trabajadores se ha documentado una relación exposición-respuesta.
- Diversos estudios epidemiológicos han informado de números estadística mente significativos de exceso de muertes o casos de desorden inmunológico y enfermedades auto inmunes en trabajadores expuestos al silicio. Estas enfermedades y trastornos incluyen scleroderma,artritis reumatoide, eritematosis sistémica y sarcoidosis.
- Estudios epidemiológicos recientes han informado de asociaciones estadística mente significativas de exposiciones ocupacionales a silicio cristalino con enfermedades renales y cambios renales subclínicos.
- El silicio cristalino puede afectar el sistema inmunitario, resultando en infecciones mico bacterianas (tuberculosas y no tuberculosas)o fúngicas, especialmente en trabajadores con silicosis.
- La exposición ocupacional al silicio cristalino respirable está asociado con bronquitis, enfermedad crónica de obstrucción pulmonar (COPD)y enfisema.Algunos estudios epidemiológicos sugieren que estos efectos sobre la salud pueden ser menos frecuentes o ausentes en los no fumadores.
- GERMANIO (GE)

- HISTORIA
- Descubridor: Clemens Winkler.
- Lugar de descubrimiento: Alemania.
- Año de descubrimiento: 1886.
- Origen del nombre: De la palabra latina "Germania",que significaba"Alemania".
- Obtención: El germanio era un elemento cuya existencia había sido predicha por Mendeleiev en 1871.Predijo que este elemento debería tener propiedades análogas al silicio y le llamó eka-silicio. Sus predicciones estaban extremadamente próximas a la realidad. Fue obtenido por Winkler del mineral argirodita.
- Es un semimetal,de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias. Preséntala misma estructura cristalina que el diamante y resiste a los ácidos y álcalis. Forma gran número de compuestos organometálicos y es un importante material semiconductor utilizado en transistores y foto detectores.A diferencia de la mayoría de semiconductores,el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
OBTENCIÓN DEL GERMANIO:
- Se obtiene como subproducto en los procesos de obtención de cobre,zinc y en las cenizas de ciertos carbones.Para la purificación ulterior se utiliza el proceso llamado fusión por zonas.
APLICACIONES:




































- Se utiliza como semiconductor.
- El germanio dopado con arsénico, galio, u otros elementos se utiliza como transistor.
- Por ser transparente a la radiación infrarroja se emplea en forma de mono cristales en espectroscopios infrarrojos (lentes, prismas y ventanas) y otros aparatos ópticos entre los que se encuentran detectores infrarrojos extremadamente sensibles.
- El óxido de germanio se aplica en lentes gran angular de cámaras y en objetivos de microscopio.
- El germanio se utiliza como detector de la radiación gamma.
- Los compuestos órgano germánicos se están utilizando en quimioterapia, pues tienen poca toxicidad para los mamíferos y son eficaces contra ciertas bacterias.

- EFECTOS DEL GERMANIO EN LA SALUD:El hidruro de germanio y el tetra hidruro de germanio son extremadamente inflamables e incluso explosivos cuando son mezclados con el aire. Inhalación: Calambres abdominales.Sensación de quemadura. Tos.Piel: Enrojecimiento.Dolor. Ojos: Enrojecimiento. Dolor. Peligros físicos: El gas es más pesado que el aire y puede viajar por el suelo; es posible la ignición a distancia. Vías de exposición: La sustancia puede ser absorbida por el cuerpo por inhalación. Riesgo de inhalación: En caso de pérdidas en el contenedores alcanzará rápidamente una concentración peligrosa del gas en el aire. Efectos de la exposición a corto plazo: La sustancia irrita los ojos,la piel y el tracto respiratorio. La sustancia puede tener efectos en la sangre, resultando en lesiones de las células sanguíneas. La exposición puede resultar en la muerte.
- ESTAÑO (SN)

- HISTORIA:
- Descubridor: Desconocido.
- Lugar de descubrimiento: Desconocido.
- Año de descubrimiento: Conocido desde la antigüedad.
- Origen del nombre: De la palabra anglosajona "tin" que significa "estaño" o
- "lata",aunque también se piensa que deriva de Tinia,la suprema diosa del cielo de los Etruscos.El origen del símbolo procede de la palabra latina "stannum"que significa "estaño".
- Obtención: El estaño se conoce desde la antigüedad y ya se menciona en el Viejo Testamento.En Mesopotamiaya se hacían armas de bronce (aleación de cobre y estaño). También los romanos recubrían con estaño el interior de recipiente de cobre.
- Es un metal plateado, maleable, que se oxida fácilmente, a temperatura ambiente, cambiando de colora un gris más opaco,y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión Se funde a baja temperatura; tiene gran fluidez cuando se funde y posee un punto de ebullición alto. es suave, flexible y resistente a la corrosión en muchos medios.Una aplicación importante es el recubrimiento de envases de acero para conservar alimentos y bebidas.Otros empleos importantes son: aleaciones para soldar, bronces,ple tres y aleaciones industriales diversas. Los productos químicos de estaño, tanto inorgánicos como orgánicos,se utilizan mucho en las industrias de galvanoplastia, cerámica y plásticos,y en la agricultura.
OBTENCIÓN DEL ESTAÑO:
- El estaño se obtiene del mineral casiterita (óxido de estaño (IV)). Dicho mineral se muele y se enriquece en dióxido de estaño por flotación, después se tuesta y se calienta con coque en un horno de reverbero con lo cual se obtiene el metal.
APLICACIONES:
- Se utiliza para producir vidrio de ventanas. Para esto se añade vidrio fundido sobre estaño fundido, en el cual flota, con lo cual se produce una superficie lisa (Proceso Pilkington).
- Debido a su estabilidad y falta de toxicidad se emplea como recubrimiento de metales: recubrimiento de hierro (hojalata) para la industria conservera;esto se hace por electrolisis o por inmersión.
- Junto a otros metales forma aleaciones de importancia industrial.: bronce (cobre y estaño), estaño de soldar (64 % de estaño y 36 % de plomo),metal de imprenta, para fabricar cojinetes 30 % estaño, antimonio y cobre)y la aleación niobio- estaño, superconductoras bajas temperaturas.
- El cloruro de estaño (II) se emplea como agente reductor. Las sales de estaño pulverizadas sobre vidrio se utilizan para producir capas conductoras que se usan en paneles luminosos y en calefacción de cristales de coche.
EFECTOS DEL ESTAÑO EN LA SALUD: El estaño se aplica principalmente en varias sustancias orgánicas. Los enlaces orgánicos de estaño son las formas más peligrosas delestaño para los humanos. A pesar de su peligro son aplicadas en gran número de industrias, tales como la industria de la pintura y del plástico, y en la agricultura a través de los pesticidas.El número de aplicaciones de las sustancias orgánicas del estaño sigue creciendo,a pesar del hecho de que conocemos las consecuencias del envenenamiento por estaño. Los efectos de las sustancias orgánicas de estaño pueden variar. Dependen del tipo de sustancia que está presente y del organismo que está expuesto a ella. El estaño trietílico es la sustancia orgánica del estaño más peligrosa para los humanos. Tiene enlaces de hidrógeno relativamente cortos. Cuantos más largos sean los enlaces de hidrógeno,menos peligrosa para la salud humana será la sustancia del estaño. Los humanos podemos absorber enlaces de estaño a través de la comida y la respiración y a través de la piel. La toma de enlaces de estaño puede provocar efectos agudos así como efectos a largo plazo.
- PLOMO (PB)

- HISTORIA
- Descubridor: Desconocido.
- Lugar de descubrimiento: Desconocido.
- Año de descubrimiento: Conocido desde la antigüedad.
- Origen del nombre: Procede del latín "plumbum";los romanos utilizaban este nombre precisamente para designar al elemento plomo.Lo llamaban "plumbum nigrum" para distinguirlo del estaño, al que llamaban "plumbum candidum".
- Obtención: Mencionado en el Éxodo; los romanos lo utilizaban en grandes cantidades para la conducción de agua. Los alquimistas creían que el plomo era el metal más antiguo y lo asociaban con el planeta Saturno. Los alquimistas gastaron una gran cantidad de tiempo intentando "transmutar" el plomo en oro.
- El plomo es un metal pesado de densidad relativa o gravedad específica 11,4 a 16 °C, de color plateado con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, in elástico y se funde con facilidad. Su fusión se produce a 327,4 °C y hierve a 1725 °C. Las valencias químicas normales son 2 y 4. Es relativamente resistente al ataque del ácido sulfúrico y del ácido clorhídrico,aunque se disuelve con lentitud en ácido nítrico y ante la presencia de bases nitrogenadas.
- El plomo es anfótero, ya que forma sales de plomo de los ácidos, así como sales metálicas del ácido plúmbico. Tiene la capacidad de formar muchas sales, óxidos y compuestos organometálicos.

OBTENCIÓN DEL PLOMO:
- El metal se obtiene a partir de los sulfuros minerales; el cual, tras un previo enriquecimiento es tostado y sinterizado en un horno, obteniendo se así el óxido de plomo (II), el cual se reduce con carbón de coque a plomo metal impuro (plomo de obra). El plomo se purifica por métodos piro metalúrgicos o electrolíticos.
APLICACIONES:
- El plomo y el dióxido de plomo se utilizan para baterías de automóviles.
- Se utiliza para fontanería, aparatos químicos y municiones.
- Se emplea para la insonorización de máquinas, pues es muy efectivo en la absorción del sonido y de vibraciones.
- Se usa como blindaje para la radiación en reactores nucleares y en equipos de rayos X.
- El óxido de plomo (II) se utiliza para la producción de vidrios de alto índice de refracción para fabricar lentes acromáticas.
- El carbonato y el cromato de plomo (II) se usan como pigmentos en las pinturas.
- El nitrato de plomo se utiliza en pirotecnia.
- El minio (óxido de plomo)mezclado con aceite de linaza se usa como pintura antioxidante.
- El sulfuro de plomo (II) presenta propiedades semiconductoras por lo cual se utiliza en células fotoeléctricas.
- El arseniato de plomo (II) se emplea como insecticida.
EFECTOS DEL PLOMO EN LA SALUD: El Plomo es un metal blando que ha sido conocido través de los años por muchas aplicaciones. Este ha sido usado ampliamente desde el 5000 antes de Cristo para aplicaciones en productos metálicos, cables y tuberías, pero también en pinturas y pesticidas.El plomo es uno de los cuatro metales que tienen un mayor efecto dañino sobre la salud humana. Este puede entrar en el cuerpo humano a través de la comida(65%), agua (20%) y aire (15%).
Las comidas como fruta, vegetales,carnes, granos, mariscos, refrescos y vino pueden contener cantidades significantes de Plomo. El humo de los cigarros también contiene pequeñas cantidades de plomo. El Plomo puede entrar en el agua potable a través de la corrosión de las tuberías. Esto es más común que ocurra cuando el agua es ligeramente ácida. Este es el porqué de los sistemas de tratamiento de aguas públicas son ahora requeridos llevar a cabo un ajuste de pH en agua que sirve para el uso del agua potable. Que nosotros sepamos,el Plomo no cumple ninguna función esencial en el cuerpo humano, este puede principalmente hacer daño después de ser tomado en la comida, aire o agua.
El Plomo puede causar varios efectos no deseados,como son:
Perturbación de la fotosíntesis hemoglobina y anemia
Incremento de la presión sanguínea
Daño a los riñones
Abortos y abortos sutiles
Perturbación del sistema nervioso
Daño al cerebro
Disminución de la fertilidad del hombre a través del daño en el esperma
Disminución de las habilidades de aprendizaje de los niños
Perturbación en el comportamiento de los niños, como es agresión, comportamiento impulsivo e hipersensibilidad.
FLEROVIO (FL)

HISTORIA
Descubridor: Equipo del Instituto Nuclear de Dubna.
Lugar de descubrimiento: Dubna,Rusia. Año de descubrimiento: 1998.
Origen del nombre: El nombre de Flerovio se le puso en honor a Gueorgui Flerov, físico nuclear soviético que fundó el Laboratorio Flerov de reacciones nucleares en Dubna, en 1957.
Hasta la fecha se han observado alrededor de 80 desintegraciones de átomos de flerovio,50 de ellas directamente y 30 de la desintegración de los elementos más pesados Livermorio y Ununoctio.
OBTENCIÓN FLEROVIO:
- Bombardeo de plutonio con calcio
APLICACIONES:
- No se conocen,pues sólo se ha podido crear un átomo de este elemento.
GRUPO V A: NITROGENOIDES El grupo del nitrógeno está compuesto por los elementos químicos del grupo 15 de la tabla periódica,que son: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb), bis muto (Bi) y el elemento sintético Moscovia (Mc), cuyo descubrimiento ya ha sido confirmado.Estos elementos también reciben el nombre de pnicógenos o nitrogenados.

- NITROGENO (N)

- HISTORIA
- Descubridor: Daniel Rutherford.
- Lugar de descubrimiento: Escocia.
- Año de descubrimiento: 1772.
- Origen del nombre: De las palabras griegas "nitron" ("nitrato")y "geno" ("generador").Significando "formador de nitratos".
- Obtención: En el estudio de la composición del aire, Joseph Black, obtuvo un gas que permitía la combustión y la vida y otro gas que no la permitía ("aire viciado"). Rutherford estudió este gas y llegó a la conclusión de que era "aire flogistizado",donde "nada ardía y nada vivía en él". Aunque no supo de qué gas se trataba, fue el primero en descubrirlo.
- En condiciones normales forma un gas diatónico (nitrógeno diatónico o molecular) que constituye del orden del 78 % del aire atmosférico
- Gran parte del interés industrial en el nitrógeno se debe a la importancia de los compuestos nitrogenados en la agricultura y en la industria química; de ahí la importancia de los procesos para convertirlo en otros compuestos.El nitrógeno también se usa para llenar los bulbos de las lámparas incandescentes y cuando se requiere una atmósfera relativamente inerte.
- El nitrógeno, consta de dos isótopos, 14 N y 15 N, en abundancia relativa de 99.635 a 0.365.Además se conocerlos isótopos radiactivos 12 N, 13 N, 16 N y 17 N, producidos por una variedad de reacciones nucleares. A presión y temperatura normales, el nitrógeno molecular es un gas con una densidad de 1.25046 g porlitro.
- COMO SE OBTIENE EL NITROGENO:
- Se obtiene de la atmósfera(su fuente inagotable) por licuación y destilación fraccionada.
- Se obtiene, muy puro, mediante descomposición térmica (70 ºC) del nitrito amónico en disolución acuosa.
- Por descomposición de amoniaco (1000 ºC) en presencia de níquel en polvo.
- APLICACIONES:
- Producción de amoniaco, reacción con hidrógeno en presencia de un catalizador. (Proceso Haber-Bosch).El amoniaco se usa como fertilizante y para producir ácido nítrico (Proceso Ostwald).
- El nitrógeno líquido se utiliza como refrigerante en la industria alimentaria: congelado de alimentos por inmersión y transporte de alimentos congelados.
- El nitrógeno se utiliza en la industria electrónica para crear atmósferas inertes para producir transistores y diodos.
- Se utiliza en la industria del petróleo para incrementar la presión en los pozos y forzar la salida del crudo.
- Se usa como atmósfera inerte en tanques de explosivos líquidos.
- El ácido nítrico, compuesto del nitrógeno, se utiliza para fabricar nitratos y nitrar sustancias orgánicas.
- El dióxido de nitrógeno se utiliza como anestésico.
- Los cianuros se utilizan para producir acero templado.
- EFECTOS DEL NITROGENO EN LA SALUD: Las moléculas de Nitrógeno se encuentran principalmente en el aire. En agua y suelos el Nitrógeno puede ser encontrado en forma de nitratos y nitritos. Todas estas substancias son parte del ciclo del Nitrógeno, aunque hay una conexión entre todos. Los humanos han cambiado radicalmente las proporciones naturales de nitratos y nitritos, mayormente debido a la aplicación de estiércoles que contienen nitrato. El Nitrógeno es emitido extensamente por las industrias, incrementando los suministros de nitratos y nitritos en el suelo y agua como consecuencia de reacciones que tienen lugar en el ciclo del Nitrógeno.
- EFECTOS DEL NITROGENO EN LA NATURALEZA: La adición de Nitrógeno enlazado en el ambiente tiene varios efectos. Primeramente, puede cambiar la composición de especies debido a la susceptibilidad de ciertos organismos a las consecuencias de los compuestos de nitrógeno. Segundo,la mayoría del nitrito puede tener varios efectos sobre la salud de los humanos así como en animales. La comida que es rica en compuestos de Nitrógeno puede causar una pérdida en el transporte de oxígeno en la sangre, lo que puede tener consecuencias serias para el ganado.
- CARACTERÍSTICAS
- Tiene reactividad muy baja.
- A temperaturas ordinarias reacciona lentamente con el litio.
- A altas temperaturas, reacciona con cromo,silicio, titanio, aluminio, boro, berilio, magnesio,bario, estroncio,calcio y litio para formar nitruros; con O2, para formar NO, y en presencia de un catalizador, con hidrógeno a temperaturas y presión bastante altas, para formar amoniaco.
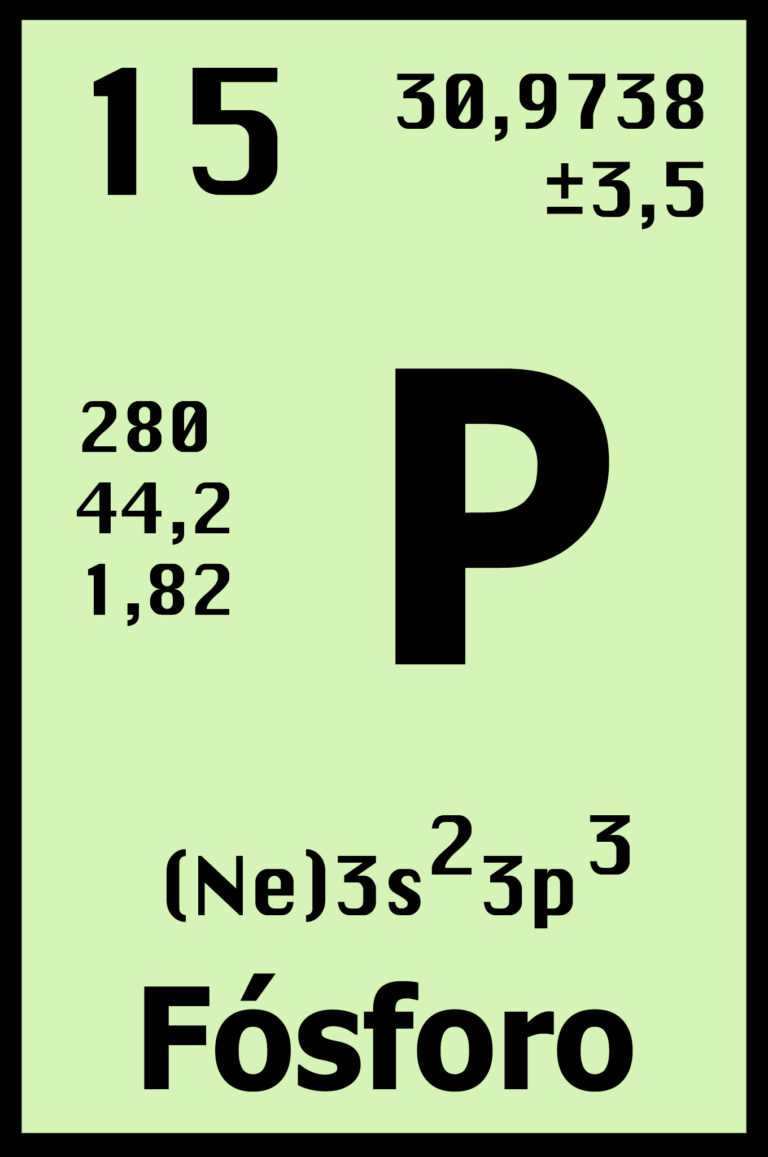
- FÓSFORO (P)

- HISTORIA
- Descubridor: Hennig Brand.
- Lugar de descubrimiento: Alemania.
- Año de descubrimiento: 1669. Origen del nombre: De la palabra griega "phosphoros" que significa "portador de luz",nombre que se correspondía con el antiguo del planeta Venus cuando aparecía antes de la salida del sol (ya que el fósforo emite luz en la oscuridad porque arde al combinarse lentamente con el oxígeno del aire).
- Obtención: Buscando la piedra filosofal, Brand destiló una mezcla de arena y orina evaporada y obtuvo un cuerpo que tenía la propiedad de lucir en la oscuridad.Durante un siglo se vino obteniendo esta sustancia exclusivamente de la orina, hasta que en 1771 Scheele la produjo de huesos calcinados.
- Es un no metal multivalente perteneciente al grupo del nitrógeno (Grupo 15 (VA): nitrogenoideos)que se encuentra en la naturaleza combinado en fosfatos inorgánicos y en organismos vivos pero nunca en estado nativo. Es muy reactivo y se oxida espontáneamente en contacto con el oxígeno atmosférico emitiendo luz.
- Este elemento puede encontrarse en pequeñas cantidades en el semen,lo que hace que este fluido resalte en un color notable ante la luz ultravioleta; esto ha permitido resolver algunos casos criminales que han involucrado una violación sexual.
- El ciclo del fósforo en las plantas es la absorción de este por la planta y su retorno a través de los residuos vegetales y animales, su fijación a las superficies de arcilla y óxidos y el recambio biológico dado por procesos de mineralización y solubilización.

- OBTENCIÓN FOSOFORO:
- Se obtiene por métodos electro químicos,en atmósfera seca, a partir del mineral (fosfato)molido mezclado con coque y arena y calentado a 1400 ºC en un horno eléctrico o de fuel. Los gases de salida se filtran y enfrían hasta 50 ºC con lo que condensa el fósforo blanco, que se recoge bajo agua o ácido fosfórico.Calentando suavemente se transforma en fósforo rojo.
- APLICACIONES:
- El fósforo rojo se usa, junto al trisulfuro de tetrafósforo,P4S3,en la fabricación de fósforos de seguridad.
- El fósforo puede utilizarse para: pesticidas,pirotecnia, bombas incendiarias, bombas de humo, balas trazadoras, etc.
- El fósforo (sobre todo blanco y rojo) se emplea principalmente en la fabricación de ácido fosfórico,fosfatos y polifosfatos (detergentes).
- El pentaóxido de fósforo se utiliza como agente desecante.
- El hidruro de fósforo,PH3 (fosfina), es un gas enormemente venenoso.Se emplea en el dopado de semiconductores en la fumigación de cereales.
- El trisulfuro de tetrafósforo constituye la masa incendiaria de las cerillas.
- Los fosfatos se usan en la producción de vidrios especiales, como los usados en las lámparas de sodio.
- El fosfato de calcio tratado con ácido sulfúrico origina superfosfato.tratado con ácido fosfórico origina superfosfato doble.Estos superfosfatos se utilizan ampliamente como fertilizantes.
- La ceniza de huesos, compuesta por fosfato de calcio, se ha usado para fabricar porcelana y producir fosfato monocálcico, que se utiliza en polvos de levadura panadera. El fosfato sódico es un agente limpiador, cuya función es ablandar el agua e impedirla formación de costras en caldera y la corrosión de tuberías y tubos de calderas.
- Los fosfatos desempeñan un papel esencial en los procesos biológicos de transferencia de energía: metabolismo, fotosíntesis,función nerviosa y muscular. Los ácidos nucleicos que forman el material genético son polifosfatos y coenzimas.
- EFECTOS DEL FÓSFORO EN LA SALUD: El Fósforo puede ser encontrado en el ambiente más comúnmente como fosfato.Los fosfatos son substancias importantes en el cuerpo de los humanos porque ellas son parte del material de ADN y tienen parte en la distribución de la energía. Los fosfatos pueden ser encontrados comúnmente en plantas. Los humanos han cambiado el suministro natural de fósforo radicalmente por la adición de estiércol ricos en fosfatos. El fósforo blanco es la forma más peligrosa de fósforo que es conocida.Cuando el fósforo blanco ocurre en la naturaleza este puede ser un peligro serio para nuestra salud. El fósforo blanco es extremadamente venenoso y en muchos casos la exposición él será fatal.
- EFECTOS DEL FÓSFORO EN EL MEDIO AMBIENTE: Fósforo blanco: El fósforo blanco estra en el ambiente cuando es usado en industrias para hacer otros productos químicos cuando el ejército lo usa como munición. A través de descargas de aguas residuales el fósforo blanco termina en las aguas superficiales cerca de las fábricas donde es usado. Fosfatos: Los fosfatos tienen muchos efectos sobre los organismos. Los efectos son mayormente consecuencias de las emisiones de grandes cantidades de fosfatos en el ambiente debido a la minería y los cultivos. Durante la purificación del agua los fosfatos no son a menudo eliminado correctamente,así que pueden expandirse a través de largas distancias cuando se encuentran en la superficie de las aguas.
- ARSÉNICO (AS)

- HISTORIA
- Descubridor: Alberto Magno.
- Lugar de descubrimiento: Desconocido.
- Año de descubrimiento: 1250 (aproximadamente).
- Origen del nombre: De la palabra griega "arsenikon".Desde la antigüedad se utilizaba un pigmento con el que se fabricaba pintura de color amarillo y que los griegos asociaban al sexo masculino, por lo cual le daban el nombre de arsenikon, que provenía de "arsen" que significaba varonil. Los romanos lo llamaron "oropimente",del latín auripigmentum; es decir, pigmento áureo o pigmento de oro, llamado así por su color amarillo.
- Obtención: Se cree que fue obtenido por Alberto Magno calentando jabón junto con oropimente (trisulfuro de diarsénico).
- El arsénico es un elemento químico de la tabla periódica que pertenece al grupo de los metaloides,también llamados semimetales, se puede encontrar de diversas formas,aunque raramente se encuentra en estado sólido. Se conoce desde la antigüedad y se reconoce como extremadamente tóxico. A presión atmosférica el arsénico sublima a 613 °C.
- Es un elemento esencial para la vida y su deficiencia puede dar lugar a diversas complicaciones.La ingesta diaria de 12 a 15 μg puede consumirse sin problemas en la dieta diaria de carnes, pescados, vegetales y cereales,siendo los peces y crustáceos los que más contenido de arsénico presentan.

OBTENCIÓN DEL ARSÉNICO:
Se obtiene a partir del mineral arsenopirita (FeAsS).Se calienta, con lo cual el arsénico sublima y queda un residuo sólido de sulfuro ferroso.
APLICACIONES:
El arsénico se utiliza en los bronces,en pirotecnia y como dopante en transistores y otros dispositivos de estado sólido.
El arseniuro de galio se emplea en la construcción de láseres ya que convierte la electricidad en luz coherente.
El óxido de arsénico (III) se emplea en la industria del vidrio, además de como veneno.
La arsina (trihidruro de arsénico) es un gas tremenda mente venenoso.
Los sulfuros de arsénico; por ejemplo,el oropimente,se usan como colorantes.
EFECTOS DEL ARSÉNICO EN LA SALUD: El Arsénico es uno de los más tóxicos elementos que pueden ser encontrados.Debido a sus efectos tóxicos,los enlaces de Arsénico inorgánico ocurren en la tierra naturalmente en pequeñas cantidades. Los humanos pueden ser expuestos al Arsénico a través de la comida, agua y aire. Los niveles de Arsénico en la comida son bastante bajos, no es añadido debido a su toxicidad, pero los niveles de Arsénico en peces y mariscos puede ser alta, porque los peces absorben Arsénico del agua donde viven. Por suerte esto esta es mayormente la forma de Arsénico orgánico menos dañina, pero peces que contienen significantes cantidades de Arsénico inorgánico pueden ser un peligro para la salud humana.
- ANTIMONIO (SB)

- HISTORIA
- Descubridor: Desconocido.
- Lugar de descubrimiento: Desconocido.
- Año de descubrimiento: Conocido desde la antigüedad.
- Origen del nombre: De la palabra griega "stíbi",pasó al latín como "stibium" (dando nombre al colorete de antimonio con el que las mujeres se daban sombra de ojos ya en el antiguo Egipto). La forma"antimonium" se formó en latín medieval por etimología popular como adaptación del árabe "at-timud", con el mismo significado.El origen del símbolo,Sb, proviene de la palabra latina stibium.
- Obtención: Los compuestos de antimonio se conocen desde la antigüedad y, como metal, a comienzos del siglo XVII. En el antiguo Egipto se empleaba el sulfuro de antimonio como ungüento, colorete y para ennegrecerlas uñas.
- Este elemento semimetálico tiene cuatro formas alotrópicas. En su forma estable es un metal blanco azulado. El antimonio negro y el amarillo son formas no metálicas inestables. Principalmente se emplean aleaciones metálicas y algunos de sus compuestos para dar resistencia contra el fuego,en pinturas, cerámicas,esmaltes, vulcanizan del caucho y fuegos artificiales.

- OBTENCIÓN DEL ANTIMONIO:
- Se obtiene fundiendo el mineral estibina, para concentrarlo en Sb2S3 y éste se tuesta a Sb2O3 que se reduce con carbón. Se purifica mediante fusión por zonas.
- Se obtiene como subproducto en los procesos metalúrgicos de cobre y plomo.
- APLICACIONES:
- Usado en la tecnología de semiconductores para fabricar detectores infrarrojos, diodos y dispositivos de efecto Hall.
- Aleado con plomo incrementa la dureza de este metal. Se usa para baterías,aleaciones anti fricción, armas pequeñas,balas trazadoras, revestimientos de cables, etc.
- El sulfuro de antimonio (III)se emplea en la obtención de antimonio, para preparar la masa inflamable de las cerillas, en fabricación de vidrios coloreados,barnices y en pirotecnia.
- El cloruro de antimonio (III)se usa como catalizador.
- EFECTOS DEL ANTIMONIO EN LA SALUD: El antimonio se da naturalmente en el medio ambiente. Pero también entra en el medio ambiente a través de diversas aplicaciones de los humanos. Especialmente las personas que trabajan con antimonio pueden sufrir los efectos de la exposición por respirar polvo de antimonio.
- La exposición de los humanos al antimonio puede tener lugar por medio de la respiración,del agua potable y de la comida que lo contenga, pero también por contacto cutáneo con tierra, agua y otras sustancias que lo contengan. Respira rantimonio enlazado con hidrógeno en la fase gaseosa es lo que produce principalmente los efectos sobre la salud.
- EFECTOS DEL ANTIMONIO EN LA NATURALEZA: El antimonio se puede encontrar en los suelos,agua y aire en cantidades muy pequeñas.El antimonio contamina principalmente los suelos.Puede viajar grandes distancias con las aguas subterráneas hacia otros lugares y aguas superficiales. Las pruebas de laboratorio con ratas, conejos y conejillos de indias nos han mostrado que niveles relativamente altos de antimonio pueden matar a pequeños animales.
- Las ratas pueden experimentar daños pulmonares, cardíacos,hepáticos y renales previos a la muerte. Los animales que respiran bajos niveles de antimonio durante un largo periodo de tiempo pueden experimentar irritación ocular, pérdida de pelo y daños pulmonares. Los perros pueden experimentar problemas cardíacos incluso cuando son expuestos a bajos niveles de antimonio. Los animales que respiran bajos niveles de antimonio durante un par de meses también pueden experimentar problemas de fertilidad.
- BISMUTO (BI)
- HISTORIA
- Descubridor: Desconocido.
- Lugar de descubrimiento: Desconocido.
- Año de descubrimiento: Conocido desde la antigüedad. Origen del nombre: De la palabra alemana "bisemutum"que significa "materia blanca",en alusión al color del elemento.
- Obtención: Sobre el siglo XIII se confundía con el plomo y el estaño. Claude Geoffrey demostró,en 1753,que era diferente del plomo. Karl Scheele y Torbern Bergman descubrieron el bismuto como elemento.
- Ocupa el lugar 73 en abundancia entre los elementos de la corteza terrestre (representa el 8,5x10-7 % del peso de la corteza) y es tan escaso como la plata. Los principales depósitos están en Sudamérica, pero en Estados Unidos se obtiene principalmente como subproducto del refinado de los minerales de cobre y plomo. Es un metal típico desde el punto de vista químico.En compuestos, tiene valencias de +3 (bismuto (III))o +5 (bismuto (V)), siendo más estables los compuestos de bismuto trivalente. El bismuto se expande al solidificarse;esta extraña propiedad lo convierte en un metal idóneo para fundiciones.Algunas de sus aleaciones tienen puntos de fusión in usualmente bajos.

- OBTENCIÓN DEL BISMUTO:
- A partir de los minerales que contienen bismuto, se obtiene el óxido de bismuto (III), el cual se reduce con carbón a bismuto bruto. Se purifica mediante fusión por zonas.
- Se obtiene como subproducto del refinado de metales como: plomo,cobre,oro, plata y estaño.
- APLICACIONES:
- Aleado junto a otros metales tales como:estaño, cadmio, ..., origina materiales de bajo punto de fusión utilizadas en sistemas de detección y extinción de incendios.
- Aleado con manganeso se obtiene el "bismanol" usado para la fabricación de imanes permanentes muy potentes.
- Se emplea en termopares y como "carrier" de 235 U o 237 U del combustible de reactores nucleares.
- Se emplea como catalizador en la obtención de fibras acrílicas.
- El óxido de bismuto (III)se emplea para fabricar vidrios de alto índice de refracción y esmaltes de color amarillo.
- El oxicloruro de bismuto, BiOCl, se emplea en cosmética y en fabricación de perlas artificiales.
- EFECTOS DEL BISMUTO EN LA SALUD: El bismuto y sus sales pueden causar daños en el hígado, aunque el grado de dicho daño es normalmente moderado.Grandes dosis pueden ser mortales. Industrial mente es considerado como uno de los metales pesados menos tóxicos.Envenenamiento grave y a veces mortal puede ocurrir por la inyección de grandes dosis en cavidades cerradas y de aplicación extensiva a quemaduras (en forma de compuestos solubles del bismuto). Se ha declarado que la administración de bismuto debe ser detenida cuando aparezca gingivitis, ya que de no hacerlo es probable que resulte en estomatitis ulcerosa. Se pueden desarrollar otros resultados tóxicos,tales como sensación indefinida de malestar corporal, presencia de albúmina u otra sustancia proteica en la orina, diarrea, reacciones cutáneas y a veces exodermatitis grave.
- EFECTOS DEL BISMUTO EN EL MEDIO AMBIENTE: El bismuto metálico no se considera tóxico y presenta una amenaza mínima para el medio ambiente. Los compuestos del bismuto son generalmente muy poco solubles pero deben ser manejados con cuidado, ya que solo se dispone de información limitada de sus efectos y destino en el medio ambiente.
GRUPO VI A: ANFIGENOS El grupo de los anfígenos o calcógenoses también llamado familia del oxígeno y es el grupo conocido antiguamente como VI A, y actualmente grupo 16 (según la IUPAC)en la tabla periódica de los elementos,formado porlos siguientes elementos: oxígeno (O), azufre (S), selenio (Se), telurio (Te), polonio ( Po) y livermorio (Lv). El nombre de anfígeno en español deriva de la propiedad de algunos de sus elementos de formar compuestos con carácter ácido o básico.

- OXIGENO (O)

- HISTORIA
- Descubridor: JosephPriestley.
- Lugar de descubrimiento: Inglaterra. Año de descubrimiento: 1774.
- Origen del nombre: Del griego "oxys" ("ácidos")y "gennao" ("generador").Significando "formador de ácidos".
- Obtención: Por calentamiento de óxido de mercurio, se obtenían dos gases:uno de ellos el mercurio que condensabay, el otro, el oxígeno,que hacía arder brillantemente una vela y permitía la respiración.
- Forma parte del grupo de los anfígenos en la tabla periódica y es un elemento no metálico altamente reactivo que forma fácilmente compuestos(especialmente óxidos)con la mayoría de elementos,excepto con los gases nobles helio y neón. Asimismo,es un fuerte agente oxidante y tiene la segunda electro negatividad más alta de todos los elementos,solo superado por el flúor. Medido por su masa, el oxígeno es el tercer elemento más abundante del universo, tras el hidrógeno y el helio, y el más abundante en la corteza terrestre,formando prácticamente la mitad de su masa. Debido a su reactividad química,no puede permanecieren la atmósfera terrestre como elemento libre sin ser reabastecido constantemente por la acción foto sintética de los organismos que utilizan la energía solar para producir oxígeno elemental a partir del agua.

- OBTENCIÓN DEL OXIGENO:
- Licuación del aire y destilación fraccionada del mismo (99% de la producción).
- Electrolisis de agua.
- Calentamiento de clorato de potasio con dióxido de manganeso como catalizador.
- Descomposición térmica de óxidos.
- Descomposición catalítica de peróxidos.
- APLICACIONES:
- Utilizado en hospitales para favorecerla respiración de los pacientes con problemas cardio respiratorios. Se debe mezclar con gases nobles, pues inhalar oxígeno puro puede ser peligroso.
- Utilizado en soldadura oxiacetilénica.
- Síntesis de metano y de óxido de etileno.
- Combustible de cohetes.
- Hornos de obtención de acero.
- Por acción de descargas eléctricas o radiación ultravioleta sobre el oxígeno se genera el ozono.
- EFECTOS DEL OXIGENO EN LA SALUD: Todo ser humano necesita oxígeno para respirar, pero como ocurre con muchas sustancias un exceso de oxígeno no es bueno. Si uno se expone a grandes cantidades de oxígeno durante mucho tiempo,se pueden producir daños en los pulmones. Respirar un 50-100% de oxígeno a presión normal durante un periodo prolongado provoca daños en los pulmones.Las personas que en su trabajo sufren exposiciones frecuentes o potencialmente elevadas a oxígeno puro, deben hacerse un chequeo de funcionamiento pulmonar antes y después de desempeñarse trabajo. El oxígeno es normalmente almacenado a temperaturas muy bajas y por lo tanto se deben usar ropas especiales para prevenir la congelación de los tejidos corporales. En condiciones normales de presión y temperatura, el oxígeno es un gas incoloro e inodoro con fórmula molecular O2, en el que dos átomos de oxígeno se enlazan con una configuración electrónica en estado triple te. Este enlace tiene un orden de enlace de dos y se suele simplificaren las descripciones como un enlace doble o como una combinación de un enlace de dos electrones y dos enlaces de tres electrones. El oxígeno triple te —no debe confundirse con el ozono, O3— es el estado fundamental de la molécula O2, que cuenta con dos electrones desparejados que ocupan dos orbitales moleculares de generados. Estos orbitales se clasifican como anti enlaces —debilitan el orden de enlace de tres a dos—,de manera que el enlace del di oxígeno es más débil que el triple enlace del nitrógeno diatómico,en el que todos los orbitales de los enlaces moleculares se rellenan, pero algunos orbitales de anti enlace no lo están.
- AZUFRE (S)

- HISTORIA
- Descubridor: Desconocido.
- Lugar de descubrimiento: Desconocido.
- Año de descubrimiento: Conocido desde la antigüedad.
- Origen del nombre: La palabra "azufre" se supone derivada de un vocablo sánscrito "sulvere" que indica que el cobre pierde su valor cuando se une con el azufre. Sulvere derivó en la palabra latina "sulphurium",que derivó en azufre.
- Obtención: El azufre se conoce desde los tiempos más remotos,pues con el nombre de "piedra inflamable" se menciona en la Biblia y en los documentos más antiguos. Se usaba en medicina y, los vapores producidos en su combustión,por griegos y romanos para blanquear telas.
- El azufre se encuentra en forma nativa en regiones volcánicas y en sus formas reducidas formando sulfuros y sulfonales o bien en sus formas oxidadas como sulfatos. Es un elemento químico esencial constituyente de los aminoácidos cisteína y metionina y, por consiguiente,necesario para la síntesis de proteínas presentes en todos los organismos vivos.
- Se usa principalmente como fertilizante pero también en la fabricación de pólvora, laxantes, fósforo se insecticidas. Los sulfuros metálicos pueden clasificarse en tres categorías:sulfuros ácidos (hiposulfurosos, MHS, donde M es igual a un ion metálico univalente), sulfuros normales (M2S) y hiposulfurosos (M2S3).

- OBTENCIÓN DEL AZUFRE:
- Se obtiene de modos salinos de la costa del Golfo de México mediante el método Frasch: se introduce agua sobre calentada (180 ºC) que funde el azufre y, con ayuda de aire comprimido, sube a la superficie.
- APLICACIONES:
- Fabricación de pólvora negra, junto a carbono y nitrato potásico.
- Vulcanización del caucho.
- Fabricación de cementos y aislantes eléctricos.
- Fabricación de cerillas, colorantes y también como fungicida (vid).
- Fabricación de ácido sulfúrico (el producto químico más importante de la industria química de cualquier país). Este ácido se emplea para: producción de abonos minerales (superfosfatos),explosivos,seda artificial, colorantes,vidrios, en acumuladores, como desecante y reactivo químico.
- El dióxido de azufre sirve para obtener ácido sulfuroso además de sulfúrico. Las sales del ácido sulfuroso tienen aplicaciones en la industria papelera, como fumigantes, blanqueadores de frutos secos,...
- EFECTOS DEL AZUFRE EN LA SALUD: El azufre se puede encontrar frecuentemente en la naturaleza en forma de sulfuros. Durante diversos procesos se añaden al medio ambiente enlaces de azufre dañinos para los animales y los hombres. Estos enlaces de azufre dañinos también se forman en la naturaleza durante diversas reacciones,sobre todo cuando se han añadido sustancias que no están presentes de forma natural. Los compuestos del azufre presentan un olor desagradable y a menudo son altamente tóxicos. En general las sustancias sulfurosas pueden tener los siguientes efectos en la salud humana:
- Efectos neurológicos y cambios comporta mentales
- Alteración de la circulación sanguínea
- Daños cardíacos
- Efectos en los ojos y en la vista
- Fallos reproductores
- Daños al sistema inmunitario
- Desórdenes estomacales y gastrointestinales
- Daños en las funciones del hígado y los riñones
- Defectos en la audición
- Alteraciones del metabolismo hormonal
- Efectos dermatológicos
- Asfixia y embolia pulmonar.
- EFECTOS DEL AZUFRE EN EL MEDIO AMBIENTE:El azufre puede encontrarse en el aire en varias formas diferentes. Puede provocar irritaciones en los ojos y garganta de los animales, cuando la toma tiene lugar a través de la inhalación del azufre en su fase gaseosa.
- El azufre se aplica extensivamente en las industrias y es emitido al aire, debido a las limitadas posibilidades de destrucción de los enlaces de azufre que se aplican. Los efectos dañinos del azufre en los animales son principalmente daños cerebrales,a través de un mal funcionamiento del hipotálamo, y perjudicar el sistema nervioso.
- SELENIO (SE)

- HISTORIA
- Descubridor: Jöns Berzelius.
- Lugar de descubrimiento: Suecia.
- Año de descubrimiento: 1817.
- Origen del nombre: De la palabra griega "selene" que significa "luna".Este nombre le fue dado por su parecido al telurio, a causa de que el telurio había sido denominado así por la tierra, a este nuevo elemento se le dio el nombre de luna.
- Obtención: En 1817,Berzelius se encontraba analizando muestras de cierto ácido sulfúrico preparado en una ciudad minera sueca y, encontró una impureza que creyó que se trataba de un nuevo metal. Al principio, pensó que debería tratarse del telurio, pero cuando aisló el metal, demostró ser algo más: un nuevo elemento que se parecía al telurio, este fue llamado selenio.
- El selenio se puede encontrar en varias formas alotrópicas. Es insoluble en agua y alcohol, ligeramente soluble en bisulfuro de carbono y soluble en éter. Presenta el efecto fotoeléctrico,convirtiendo la luz en electricidad,y, además, su conductividad eléctrica aumenta al exponerlo a la luz. Por debajo de su punto de fusión es un material semiconductor tipo p, y se encuentra en su forma natural.
- La abundancia de este elemento,ampliamente distribuido en la corteza terrestre, se estima aproximadamente en 7 x 10-5 % por peso, encontrándose en forma de seleniuros de elementos pesados y, en menor cantidad, como elemento libre en asociación con azufre elemental. Sus minerales no se encuentran en suficiente cantidad para tener utilidad, como fuente comercial del elemento, y por ello los minerales de sulfuro de cobre seleníferos son los que representan la fuente primaria.

- OBTENCIÓN DEL SELENIO:
- Se obtiene del ánodo de una cuba electrolítica utilizada para el proceso de refinado del cobre y de la plata. El selenio se recupera por tostación de los lodos anódicos,formándose el dióxido de selenio que, por reacción con dióxido de azufre, origina el selenio.
- APLICACIONES
- El selenio presenta propiedades fotovoltaicas (convierte directamente luz en electricidad)y foto conductivas (la resistencia eléctrica decrece al aumentar la iluminación). todo esto lo hace útil en la producción de foto células y exposímetros para uso fotográfico y en células solares.
- El selenio es capaz de convertir corriente alterna en corriente continua, por lo que se emplea en rectificadores. Por debajo de su punto de fusión es un semiconductor tipo p, con aplicaciones en electrónica.
- Se emplea en xerografía para fotocopiadoras,en la industria del vidrio para de colorar vidrios y en la obtención de vidrios y esmaltes color rubí.
- Se usa como tener fotográfico,aditivo de aceros inoxidables y aleaciones de cobre.
- EFECTOS DEL SELENIO EN LA SALUD: Los humanos pueden estar expuestos al selenio de varias formas diferentes.La exposición al selenio tiene lugar bien a través de la comida o el agua, o cuando nos ponemos en contacto con tierra o aire que contiene altas concentraciones de selenio.Esto no es muy sorprendente,porque el selenio se da naturalmente en el medio ambiente de forma muy amplia y está muy extendido. La exposición al selenio tiene lugar principalmente a través de la comida, porque el selenio está presente naturalmente en los cereales y la carne. Los humanos necesitan absorbe ciertas cantidades de selenio diariamente, con el objeto de mantener una buena salud. La comida normalmente contiene suficiente selenio para prevenir las enfermedades causadas por su carencia. La toma de selenio a través de la comida puede ser más elevada de lo normal en muchos casos,porque en el pasado se aplicaron muchos fertilizantes ricos en selenio en los cultivos.
- EFECTOS DEL SELENIO EN EL MEDIO AMBIENTE: El selenio se presenta naturalmente en el medio ambiente. Es liberado tanto a través de procesos naturales como de actividades humanas. En su forma natural el selenio como elemento no puede ser creado ni destruido,pero tiene la capacidad de cambiar de forma. Bajos niveles de selenio pueden terminar en suelos o agua a través de la erosión de las rocas. Será entonces tomado por las plantas o acabará en el aire cuando es absorbido en finas partículas de polvo. Es más probable que el selenio entre en el aire a través de la combustión de carbón y aceite, en forma de dióxido de selenio.Esta sustancia será transformada en ácido de selenio en el agua o el sudor.
- TELURO (TE)

- HISTORIA
- Descubridor: Franz Joseph Muller von Reichstein.
- Lugar de descubrimiento: Rumania.
- Año de descubrimiento: 1782.
- Origen del nombre: De la palabra latina "tellus" que significa "Tierra", en honor a la diosa romana Tellus que personificaba a la Tierra en la mitología latina.
- Obtención: Fue descubierto en minerales de oro por Muller von Reichstein, inspector jefe de minas en Transilvania, en 1782. En principio se confundió con el antimonio. Fue Klaproth, en 1798, quien aisló el metal y lo llamó Telurio.
- El telurio es un elemento relativamente estable, insoluble en agua y ácido clorhídrico,pero soluble en ácido nítrico y en agua regia. Reacciona con un exceso de cloro para formar di cloruro de teluro, TeCl2 y tetracloruro de teluro, TeCl4. Se oxida con ácido nítrico y produce dióxido de teluro, TeO2,y con ácido crómico para dar ácido telúrico, H2TeO4. En combinación con el hidrógeno y ciertos metales, forma telururos, como el telururo de hidrógeno,H2Te, y el telurio de sodio,Na2Te. El teluro tiene un punto de fusión de 452° C, un punto de ebullición de 990° C, y una densidad relativa de 6,25. Su masa atómica es 127,60.

- OBTENCIÓN DEL TELURO:
- Se obtiene de los barros anódicos del refinado electrolítico del cobre.
- APLICACIÓN:
- Es un semiconductor tipo p.
- Aleado con plomo previene la corrosión de este ultimo.
- Se alea con hierro colado,acero y cobre para favorecer su mecanizado.
- El telurio se emplea en cerámica.
- El telururo de bismuto se emplea para dispositivos termoeléctricos.
- EFECTOS DEL TELURO EN LA SALUD: Vías de exposición: La sustancia puede ser absorbida por el cuerpo por medio de la inhalación de su aerosol. Riesgo de inhalación: La evaporación a 20°C es insignificante; sin embargo cuando se dispersase puede alcanzar rápidamente una concentración dañina de partículas suspendidas en el aire. Efectos de la inhalación: Somnolencia. Boca seca. Gusto metálico. Dolor de cabeza. Olor a ajo. Náuseas. Efectos de la exposición a corto plazo: El aerosol de esta sustancia irrita los ojos y el tracto respiratorio.
- La sustancia puede tener efectos en el hígado y el sistema nervioso central. La exposición puede resultar en aliento de ajo. Se recomienda observación médica. Ingestión:Dolores abdominales.Estreñimiento. Vómitos. Peligros químicos: Cuando se calienta se forman vapores tóxicos. Reacciona vigorosamente con halógenos o interhalógenos provocando riesgo de incendio. Reacciona con el zinc con incandescencia.El siluro de litio ataca al teluro con incandescencia.Combustible.Las partículas dispersas en el aire forman mezclas explosivas en el aire.
- EFECTOS DEL TELURO EN EL MEDIO AMBIENTE: No es peligroso o es fácilmente transformado en inocuo por procesos naturales. Cuando es calentado para des componerlo,el cloruro de teluro puede emitir vapores tóxicos de teluro y cloro.
- POLONIO (PO)

- HISTORIA
- Descubridor: Marie Curie.
- Lugar de descubrimiento: Francia.
- Año de descubrimiento: 1898.
- Origen del nombre: De "Polonia", lugar de nacimiento de Marie Curie.
- Obtención: Fue el primer elemento descubierto por Marie Sklodowska Curie, al intentar encontrar el origen de la radiactividad de la pechblenda de Joachimsthal (Bohemia). Se necesitaron varias toneladas del mineral pechblenda para obtener cantidades ínfimas de polonio. Aislaron el polonio mediante mediciones de la radiactividad, aquellos montones del mineral que más radiactividad emitían eran los que contenían polonio. Fue así como lo fueron concentrando hasta aislarlo.
- Esta sustancia se disuelve con mucha facilidad en ácidos, pero es sólo ligeramente soluble en alcalinos. Está químicamente relacionado con el teluro y el bismuto. El polonio es un metal volátil, reducible al 50% tras 45 horas al aire a una temperatura de 54,8 °C (328 K). Ninguno de los alrededor de 50 isotopos de polonio es estable.
- Es extremadamente tóxico y altamente radiactivo. Se ha encontrado polonio en minerales de uranio, humo de tabaco y como contaminante. Todos los elementos a partir del polonio son significativamente radiactivos. Se encuentra en el grupo 16 y su número atómico es 84.

- OBTENCIÓN DEL POLONIO
- Bombardeando bismuto natural (Bi) con neutrones se obtiene el isotopo del bismuto Bi, el cual mediante desintegración origina el polonio.
- APLICACIONES:
- Mezclado o aleado con berilio es una fuente de neutrones.
- Se emplea en cepillos para eliminar el polvo de películas fotográficas.
- Se utiliza en fuentes termoeléctricas ligeras para satélites espaciales, ya que casi toda la radiación alfa que emite es atrapada por la propia fuente sólida y por el contenedor.
- EFECTOS DEL POLONIO EN LA SALUD: El polonio es estudiado en unos pocos laboratorios de investigación donde por su alta radio actividad como emisor de partículas alfa requiere técnicas y precauciones especiales de manejo. El polonio 210 es el único componente del humo de los cigarros que ha producido cáncer por sí mismo en animales de laboratorio por inhalación. Los tumores aparecen con un nivel de polonio 210 cinco veces más bajo que la dosis de una persona que fuma mucho.
- Las tasas de cáncer de pulmón entre los hombres no pararon de ascender desde serraras en 1930 (4/100.000poraño) a ser el causante número uno de las muertes por cáncer en 1980 (72/100.000) a pesar de una reducción de casi el 20 por ciento de fumadores.Pero durante el mismo periodo,el nivel de polonio 210 en el tabaco americano se había triplicado. Esto coincidió con el aumento del uso de fertilizantes fosfatados porlos cultivadores de tabaco.
- EFECTOS DEL POLONIO EN EL MEDIO AMBIENTE: No se conocen bien las fuerzas ambientales y bioquímicas que pueden tender a reconcentrar estos materiales tóxicos en las células vivas. Aunque el polonio se da en la naturaleza, se ha vuelto mucho más disponible para entrar en el agua, la comida, las células vivas y los tejidos a partir de la explosión de la minería que empezó poco después de la segunda guerra mundial.
GRUPO VII A: HALOGENOS Los halógenos (del griego,formador de sales)son los elementos químicos que forman el grupo 17 (XVII A, utilizado anteriormente) o grupo VII A de la tabla periódica:flúor (F), cloro(Cl), bromo (Br), yodo (I), astato (At) y téneso (Ts). Este último también está en los metales del bloque f. En estado natural se encuentran como moléculas diatómicas químicamente activas [X2]. Para llenar por completo su último nivel energético (s2 p5 )necesitan un electrón más, por lo que tienen tendencia a formar un ion mononegativo, X- . Este ion se denomina haluro;las sales que lo contienen se conocen como haluros. Poseen una electro negatividad ≥ 2,5 según la escala de Pauling, presentando el flúor la mayor electro negatividad,y disminuyendo ésta al bajar en el grupo. Son elementos oxidantes (disminuyendo esta característica al bajar en el grupo), y el flúor es capaz de llevar a la mayor parte de los elementos al mayor estado de oxidación.

- FLÚOR (F)

- HISTORIA
- Descubridor: Henri Moissan.
- Lugar de descubrimiento: Francia.
- Año de descubrimiento: 1886.
- Origen del nombre: De la palabra latina "fluere",que significa "fluir".
- Obtención: El flúor fue un elemento que se resistió mucho a ser aislado. Los químicos sabían dónde encontrarlo, pero resultaba muy difícil separarlo de sus compuestos por su gran reactividad química. Finalmente, fue aislado por Moissan, efectuando una electrolisis de una disolución de fluoruro potásico en ácido fluorhídrico anhidro líquido.Para albergar el gas empleó un recipiente de platino y de iridio.
- El flúor es el elemento químico de número atómico 9 situado en el grupo de los halógenos (grupo 17) de la tabla periódica de los elementos.Su símbolo es F. Es un gas a temperatura ambiente, de color amarillo pálido, formado por moléculas diatómicas F2. Es el más electronegativo y reactivo de todos los elementos.En forma pura es altamente peligroso,causando graves quemaduras químicas al contacto con la piel. El telurio se utilizó inicialmente como aditivo del acero para incrementar su ductilidad, como abrillantador en electro plateados, como aditivo en catalizadores para la desintegración catalítica del petróleo,como material colorante de vidrios y como aditivo del plomo para incrementar su fuerza y resistencia a la corrosión.

- OBTENCIÓN DEL FLÚOR:
- Mediante electrolisis de fluoruro ácido de potasio anhidro (KF · 3HF) fundido a temperaturas entre 70 - 130 ºC.
- Como subproducto en la síntesis de ácido fosfórico y superfosfatos.
- APLICACIONES:
- Enriquecimiento del isotopo fisionable 235 U, mediante formación del hexafluoruro de uranio y posterior separación por difusión gaseosa.
- Propelente de cohetes.
- El ácido fluorhídrico se emplea para: grabado de vidrio, tratamiento de la madera, semiconductores y en la fabricación de hidrocarburos fluorados.
- En pequeñas cantidades, el ion fluoruro previene la caries dental. el ion fluoruro facilita la formación de fluoroapatito, Ca5(PO4)3F,en lugar de apatito, Ca5(PO4)3(OH), más soluble en ácidos.Debe añadirse al agua para impedirla caries (se añade en forma de Na2SiF6, NaF y HF en concentraciones de 1 mg / l).
- El hexafluoruro de azufre se utiliza como material dieléctrico.
- La criolita, Na2AlF6 se utiliza como electrólito en la metalurgia del aluminio.
- El fluoruro de calcio se introduce en alto horno y reduce la viscosidad de la escoria en la metalurgia del hierro.
- EFECTOS EN LA SALUD: En el agua, aire, plantas y animales hay presentes pequeñas cantidades de flúor. Como resultado los humanos están expuestos al flúor a través de los alimentos y el agua potable y al respirar el aire. El flúor se puede encontrar en cualquier tipo de comida en cantidades relativamente pequeñas. Se pueden encontrar grandes cantidades de flúor en el té y en los mariscos. El flúor es esencial para mantener la solidez de nuestros huesos. El flúor también nos puede proteger del decaimiento dental, si es aplicado con el dentifríco dos veces al día. Si se absorbe flúor con demasiada frecuencia,puede provocar caries, osteoporosis y daños a los riñones, huesos,nervios y músculos. Las industrias liberan la forma gaseosa del flúor. Este gas es muy peligroso,ya que en elevadas concentraciones puede causar la muerte. En bajas concentraciones puede causar irritaciones de los ojos y la nariz.
- EFECTOS EN EL MEDIO AMBIENTE: El flúor está presente en la corteza terrestre de forma natural, pudiendo ser encontrado en rocas, carbón y arcilla. Los fluoruros son liberados al aire cuando el viento arrastra el suelo. Los procesos de combustión en las industrias pueden liberar fluoruro de hidrógeno al aire. Los fluoruros que se encuentran en el aire acabarán depositándose en el suelo o en el agua. Cuando el flúor se fija a partículas muy pequeñas puede permanecer en el aire durante un largo periodo de tiempo.Cuando el flúor del aire acaba en el agua se instala en los sedimentos.Cuando acaba en los suelos,el flúor se pega fuertemente a las partículas del suelo. En el medio ambiente el flúor no puede ser destruido;solamente puede cambiar de forma. El flúor que se encuentra en el suelo puede acumularse en las plantas. La cantidad de flúor que tomen las plantas depende del tipo de planta, del tipo de suelo y de la cantidad y tipo de flúor que se encuentre en el suelo. En las plantas que son sensibles a la exposición del flúor incluso bajas concentraciones de flúor pueden provocar daños en las hojas y una disminución del crecimiento.
- CLORO (CL)

- HISTORIA
- Descubridor: Carl William Scheele.
- Lugar de descubrimiento: Suecia.
- Año de descubrimiento: 1774.
- Origen del nombre: De la palabra griega "chloros",que significa "verde pálido", reflejando el color del gas.
- Obtención: Scheelehizo reaccionar al mineral pirolusita (dióxido de manganeso, MnO2) con ácido clorhídrico.La reacción química produjo un gas verdoso con un olor sofocante y desagradable.
- El cloro es un elemento químico de número atómico 17 situado en el grupo de los halógenos (grupo VIIA)de la tabla periódica de los elementos.Su símbolo es Cl. En condiciones normales y en estado puro formadicloro: un gas tóxico amarillo-verdoso formado por moléculas diatómicas (Cl2) unas 2,5 veces más pesado que el aire, de olor desagradable y tóxico.
- Es un elemento abundante en la naturaleza y se trata de un elemento químico esencial para muchas formas de vida. El cloro es uno de los cuatro elementos químicos estrechamente relacionados que han sido llamados halógenos. El flúor es el más activo químicamente;el yodo y el bromo son menos activos.
- El cloro reemplaza al yodo y al bromo de sus sales. Interviene en reacciones de sustitución o de adición tanto con materiales orgánicos como inorgánicos. El cloro seco es algo inerte, pero húmedo se combina directamente con la mayor parte de los elementos.

- OBTENCIÓN DEL CLORO:
- Electrolisis de cloruros o del ácido clorhídrico. Se obtiene como subproducto de la obtención de metales alcalinos y alcalino- térreos.
- APLICACIONES:
- Potabilizar y depurar el agua para consumo humano.
- Producción de papel, colorantes ,textiles, productos derivados del petróleo,antisépticos,insecticidas,medicamentos, disolventes,pinturas, plásticos,etc.
- En grandes cantidades,el cloro es consumido,para: productos sanitarios, blanquean tés, desinfectantes y productos textiles.
- Producción de ácido clorhídrico,cloratos (usados como oxidantes, fuentes de oxígeno en fósforos en explosivos), cloroformo y tetracloruro de carbono (estas dos últimas sustancias se emplean para obtener refrigerantes,propulsores y plásticos).
- En la extracción de bromo.
- EFECTOS EN LA SALUD: El cloro es un gas altamente reactivo. Es un elemento que se da de forma natural. Los mayores consumidores de cloro son las compañías que producen dicloruro de etileno y otros disolventes clorinados, resinas de cloruro de polivinilo (PVC), clorofluoro carbonos (CFCs)y óxido de propileno. Las compañías papeleras utilizan cloro para blanquear el papel. Las plantas de tratamiento de agua y de aguas residuales utilizan cloro para reducir los niveles de microorganismos que pueden propagar enfermedades entre los humanos (desinfección).
- La exposición al cloro puede ocurrir en el lugar de trabajo o en el medio ambiente a causa de escapasen el aire, el agua o el suelo. Las personas que utilizan lejía en la colada y productos químicos que contienen cloro no suelen estar expuestas a cloro en sí. Generalmente el cloro se encuentra solamente en instalaciones industriales. El cloro entra en el cuerpo al ser respirado el aire contaminado o al ser consumido con comida o agua contaminadas. No permanece en el cuerpo,debido a su reactividad.
- EFECTOS EN EL MEDIO AMBIENTE: El cloro se disuelve cuando se mezcla con el agua. También puede escaparse del agua e incorporarse al aire bajo ciertas condiciones.La mayoría de las emisiones de cloro al medio ambiente son al aire y a las aguas superficiales. Una vez en el aire o en el agua, el cloro reacciona con otros compuestos químicos.Se combina con material inorgánico en el ahua para formar sales de cloro, y con materia orgánica para formar compuestos orgánicos clorinados. Debido a su reactividad no es probable que el cloro se mueva a través del suelo y se incorpore a las aguas subterráneas.
- BROMO (BR)

- HISTORIA
- Descubridor: Antoine J. Balard.
- Lugar de descubrimiento: Francia.
- Año de descubrimiento: 1826.
- Origen del nombre: De la palabra griega "brómos" que significa "fetidez",debido al fuerte y desagradable olor de este elemento, sobre todo de sus vapores.
- Obtención: El químico francés Balard, que estaba trabajando con sales precipitadas del agua de los pantanos de Montpellier, descubrió que, al añadir ciertos productos químicos,aparecía una sustancia de color pardo, irritante y de olor desagradable,se comprobó que era un nuevo elemento químico:el bromo.
- El bromo a temperatura ambiente es un líquido rojo, volátil y denso. Su reactividad es intermedia entre el cloro y el yodo. En estado líquido es peligroso para el tejido humano y sus vapores irritan los ojos y la garganta. El bromo y sus compuestos se usan como agentes desinfectantes en albercas y agua potable. Algunos de sus compuestos son más seguros que los análogos de cloro, por la persistencia residual de los últimos.
- Otros compuestos químicos del bromo se utilizan como fluidos de trabajo en medidores,fluidos hidráulicos, intermediarios en la fabricación de colorantes, en acumuladores, en supresores de explosión y sistemas de extinción de fuego.La densidad de los compuestos de bromo también los hace útiles en la separación gradual del carbón y otros minerales por gradientes de densidad.La gran aplicabilidad de los compuestos de bromo se comprueba en el uso comercial de cerca de 100 compuestos de bromo.

- MÉTODOS DE OBTENCIÓN:
- Oxidación de bromuros con cloro.El bromo que se obtiene se condensa,destila y deseca.
- En el laboratorio se obtiene por acción del ácido sulfúrico sobre bromuro potásico con dióxido de manganeso como catalizador.
- APLICACIONES:
- Su principal aplicaciones la obtención del 1,2- dibromoetano, CH2Br-CH2Br, que se añade a la gasolina para evitar que los óxidos de plomo se depositen en los tubos de escape, ya que reacciona con el plomo para formar dibromuro de plomo, volátil, que sale al aire y provoca graves problemas de salud. La reducción del plomo tetraetilo (antidetonante) en las gasolinas ha afectado seriamente a la producción de bromo.
- El bromuro de metilo se emplea como fumigante.
- El hexabromobenceno y el hexabromociclododecano se emplean como agentes anti inflamables.
- El bromo se emplea en la fabricación de fibras artificiales.
- El bromo se usa para la desinfección de aguas de piscinas.
- Los bromuros inorgánicos (bromuro de plata) se emplean en fotografía.
- EFECTOS DE LA SALUD: El bromo es un elemento que se da en la naturaleza y que puede encontrarse en muchas sustancias inorgánicas. Los humanos, sin embargo,empezaron hace muchos años a introducir bromuros orgánicos en el medio ambiente. Estos son todos ellos compuestos que no son naturales y pueden causar graves daños a la salud humana y el medio ambiente. Los humanos podemos absorber bromuros orgánicos a través de la piel, con la comida y durante la respiración.Los bromuros orgánicos son ampliamente usados como sprays para matar insectos y otras plagas no deseadas.Pero no solo son venenosas para los animales contra los que son usados,sino también para los animales más grandes. En muchos casos también son venenosos para los humanos.
- EFECTOS EN EL MEDIO AMBIENTE: Los bromuros orgánicos son a menudo aplicados como agentes desinfectantes y protectores,debido a sus efectos perjudiciales para los microorganismos.Cuando se aplican en invernaderos y en campos de cultivo pueden ser arrastrados fácilmente hasta las aguas superficiales,lo que tiene efectos muy negativos para la salud de las daphnia, peces,langostas y algas. Los bromuros orgánicos son también perjudiciales para los mamíferos, especialmente cuando se acumulan en los cuerpos de sus presas.Los efectos más importantes sobre los animales son daños nerviosos y daños en el ADN, lo que puede aumentar las probabilidades de desarrollar cáncer. La toma de bromuro orgánico tiene lugar a través de la comida,de la respiración y a través de la piel. Los bromuros orgánicos no son muy biodegradables;cuando son descompuestos se forman bromuros inorgánicos. Éstos pueden dañar el sistema nervioso si son absorbidos engrandes dosis.Ha ocurrido en el pasado que los bromuros orgánicos terminaron en la comida del ganado. Miles de vacas y cerdos tuvieron que ser sacrificados para prevenir el contagio a los humanos.
- YODO (I)

- HISTORIA
- Descubridor: Bernard Courtois.
- Lugar de descubrimiento: Francia.
- Año de descubrimiento: 1811.
- Origen del nombre: De la palabra griega "iodes" que significa "violeta",aludiendo al color de los vapores del yodo.
- Obtención: Courtois estaba experimentando con las cenizas de algas, una buena fuente de sodio y potasio. al tratar las cenizas con un ácido fuerte (ácido sulfúrico) para retirar los compuestos de azufre, Courtois se percató de que salía un vapor de color violeta. Al enfriarlos obtuvo unos cristales oscuros y decidió que era un nuevo elemento,al que llamó yodo.
- Este elemento puede encontrarse en forma molecular como yodo diatómico. Es un oligoelemento y se emplea principalmente en medicina, fotografía y como colorante. Químicamente,el yodo es el halógeno menos reactivo y electronegativo.Como con todos los otros halógenos (miembros del Grupo XVII en la tabla periódica),el yodo forma moléculas diatómicas y por ello forma el diyodo de fórmula molecular I El yodo se encuentra con profusión,aunque rara vez en alta concentración y nunca en forma elemental.
- A pesar de la baja concentración del yodo en el agua marina, cierta especie de alga puede extraer y acumular el elemento.En la forma de yodato de calcio, el yodo se encuentra en los mantos de caliche de Chile. Se encuentra también como ion yoduro en algunas salmueras de pozos de petróleo en California, Michigan y Japón. El único isótopo estable del yodo es el 127 I (53 protones, 74 neutrones). De los 22 isótopos artificiales (masas entre 117 y 139), el más importante es el 131 I, con una vida media de 8 días; se utiliza mucho en el trabajo con trazadores radiactivos y ciertos procedimientos de radioterapia.

- MÉTODOS DE OBTENCIÓN:
- Mediante reacción química del yodato de calcio con dióxido de azufre.
- Por extracción de las cenizas de algas. Para obtenerlo ultra puro se hace reaccionar yoduro potásico con sulfato de cobre.
- APLICACIONES:
- El yodo se emplea como desinfectante de aguas, catalizador en la fabricación de gomas y colorantes.
- El yoduro de plata se emplea en fotografía.
- Se emplea en medicina: ingestión de yoduros y tiroxina (que contiene yodo), el agua de yodo se emplea como desinfectante de heridas.
- Se adiciona, en forma de yoduro, a la sal de mesa, para evitar carencias alimentarias y posibles problemas de bocio.
- EFECTOS EN LA SALUD: El yodo se añade a casi cualquier sal. Es un ingrediente del pan, los peces marinos y las plantas oceánicas.El yodo está presente de forma natural en los océanos y algunos peces marinos y plantas acuáticas lo almacenan en sus tejidos. Muchas medicinas y limpiadores para heridas de la piel contienen yodo. También es un ingrediente de las tabletas purificadoras de agua que se usan para preparar agua potable. El yodo es un material de construcción de las hormonas tiroideas que son esenciales para el crecimiento,el sistema nervioso y el metabolismo.Las personas que comen muy poco o nada de pan pueden experimentar carencia de yodo. Entonces la función de la glándula tiroides disminuirá y la glándula tiroides empezará a hincharse. Este fenómeno se llama estruma. Ahora esta afecciones rara, ya que la sal de mesalleva una pequeña dosis de yodo. Grandes cantidades de yodo pueden ser peligrosas porque la glándula tiroides trabajaría demasiado.Esto afecta al cuerpo entero; provoca taquicardias y pérdida de peso.El yodo elemental, I2, es tóxico, y su vapor irrita los ojos y los pulmones.La concentración máxima permitida en aire cuando se trabaja con yodo es de solamente 1 mg/m3 . Todos los yoduros son tóxicos tomados en exceso.
- EFECTOS EN EL MEDIO AMBIENTE: El yodo puede encontrarse en el aire, el agua y el suelo de forma natural. Las fuentes más importantes de yodo natural son los océanos. El yodo en el aire se puede combinar con partículas de agua y precipitar en el agua o los suelos. El yodo en los suelos se combina con materia orgánica y permanece en el mismo sitio por mucho tiempo.Las plantas que crecen en estos suelos pueden absorber yodo. EL ganado y otros animales absorberán yodo cuando coman esas plantas. El yodo en las aguas superficiales se evaporará y volverá a entrar en el aire. Los humanos también añadimos yodo al aire, al quemar carbón o fuel para producir energía. Pero la cantidad de yodo que entra en el aire debido a la actividad humana es bastante pequeña comparada a la cantidad que se evapora de los océanos.
- ASTATO (AT)

- HISTORIA
- Descubridor: Dale Corson, K. MacKenzie, Emilio Segrè.
- Lugar de descubrimiento: USA.
- Año de descubrimiento: 1940.
- Origen del nombre: De la palabra griega "astatos"que significa "inestable",debido a que este elemento carecía de isótopos estables.
- Obtención: Se obtuvo bombardeando el isótopo de bismuto 209 Bicon partículas alfa.
- El comportamiento químico de este elemento altamente radiactivo es muy similar al de otros halógenos, especialmente el yodo. Se piensa que el ástato es más metálico que el yodo. Investigadores del Laboratorio Nacional de Brookhaven han realizado experimentos en los que se han identificado y medido reacciones elementales que involucran al ástato. El ástato, seguido del francio, es el elemento más raro de la naturaleza, con una cantidad total sobre la superficie terrestre menor de 25 gramos en el mismo instante de tiempo.1 Todos los isótopos conocidos delástato son de vida corta; el más estable de éstos, es el ástato-210, cuya vida data de aproximadamente 8,1 horas. El ástato elemental nunca ha sido observado,ya que cualquier muestra macroscópicasería inmediatamente vaporizada, debido a su calentamiento radiactivo; aún no se ha determinado con exactitud si este obstáculo puede ser superado exponiendo al ástato a una refrigeración adecuada.

MÉTODOS DE OBTENCIÓN:
Se obtiene de la misma manera en que se hizo inicialmente, es decir, bombardeando elisótopo 209-Biconpartículas alfa.
APLICACIONES:
No posee
EFECTOS EN LA SALUD: La cantidad total de ástato en la corteza terrestre es menor de 30 gramos y solo unos pocos microgramoshan sido producidos artificialmente. Esto,junto con su corta vida, no deja ninguna razón para considerarlos efectos del ástato en la salud humana. El ástato se estudia en unos pocos laboratorios de investigación donde su alta radioactividad requiere precauciones y técnicas de manipulación especiales.El ástato es un halógeno y posiblemente se acumule en la glándula tiroides como el yodo. Desde un punto de vista químico,se puede especular que su toxicidad será idéntica a la del yodo.
EFECTOS EN EL MEDIO AMBIENTE: El ástato no se da en cantidades significativas en la biosfera,así que normalmente nunca presenta riesgos.
WEBGRAFIA




